- Cancer Commun | 喜訊!武漢同濟醫院張必翔團隊團隊發現肝癌治療新靶標
- 2024年08月09日來源:中國網
提要:肝細胞癌(HCC)是全球第四大癌癥死亡原因,致死率極高。當前針對晚期HCC的治療方法,主要靶向腫瘤免疫微環境(TIME),而非直接針對腫瘤細胞。前期的研究表明異常的ac4C(N4-乙酰胞苷)修飾與多種實體瘤的進展有關,但是,ac4C在HCC進展中明確的生物學意義和關鍵的機制仍然是個謎。
肝細胞癌(HCC)是全球第四大癌癥死亡原因,致死率極高。當前針對晚期HCC的治療方法,主要靶向腫瘤免疫微環境(TIME),而非直接針對腫瘤細胞。前期的研究表明異常的ac4C(N4-乙酰胞苷)修飾與多種實體瘤的進展有關,但是,ac4C在HCC進展中明確的生物學意義和關鍵的機制仍然是個謎。2024年7月,武漢同濟醫院張必翔團隊一篇題為“Targeting N4-acetylcytidine suppresses hepatocellular carcinoma progression by repressing eEF2-mediated HMGB2 mRNA translation”的研究成果發表在Cancer Communications期刊上,該研究揭示了NAT10-ac4C/eEF2-HMGB2表觀轉錄組軸在調節HCC生長和轉移中的關鍵作用,且驗證了帕比司他(Panobinostat)是針對NAT10介導的ac4C的一種有效且安全的先導化合物,具有潛在的肝癌治療價值。
邁維代謝為該研究提供了RNA甲基化靶向代謝組學檢測!

研究方法
組學方法:ac4C靶向檢測、轉錄組測序、acRIP-seq、DIA定量蛋白組檢測等;
其他方法:qRT-PCR、Western blot分析、細胞培養、轉染和病毒轉導、免疫組化(IHC)檢測等;
研究結果
1.RNA ac4C高乙酰化和NAT10上調與肝癌預后不良相關
為了闡明ac4C修飾在肝細胞癌(HCC)中的功能作用,研究人員檢測了20例HCC組織和癌旁組織中RNA ac4C 的水平。點印跡(Dot blot)實驗顯示,HCC組織總RNA中ac4C水平顯著升高(圖1A)。這一發現通過超高效液相色譜-串聯質譜(UPLC-MS/MS)RNA甲基化靶向代謝組分析進一步得到證實,該分析顯示HCC組織mRNA中ac4C水平顯著升高(圖1B)。比較了20對HCC和正常肝組織中NAT10(負責ac4C修飾的唯一乙酰轉移酶)的mRNA水平,結果表明NAT10在HCC中顯著上調,并且在20例HCC組織中NAT10表達與 RNA ac4C水平之間存在顯著相關性。為了進一步驗證這些結果,研究人員對來自89組HCC患者的數據進行了大規模數據挖掘分析。其中62個隊列內mRNA NAT10 水平有顯著變化。54個隊列HCC組織中mRNA NAT10 水平顯著升高(圖1C)。接下來,使用來自臨床蛋白質組學腫瘤分析聯盟(CPTAC)的數據集進行了基因表達分析,該數據集支持NAT10在HCC中的上調(圖1D)。與這些發現一致,通過蛋白質印跡法分析,人HCC組織中NAT10的蛋白質水平顯著高于癌旁組織(圖1E)。對來自HCC組織微陣列(同濟隊列)的103對樣本的免疫組織化學分析,進一步證實了HCC樣本中NAT10的上調(圖1F)。此外,NAT10的高表達與HCC患者的總生存期和無復發生存期顯著縮短有關(圖1G)。
后續分析表明,NAT10高表達與患者HCC組織和與不良預后相關的分子亞型iCluster-1 HCC樣本中的臨床晚期顯著相關。NAT10表達在HCC發展過程中逐漸增加(圖1H)。綜上所述,這些發現表明NAT10表達與HCC的惡性進展密切相關。
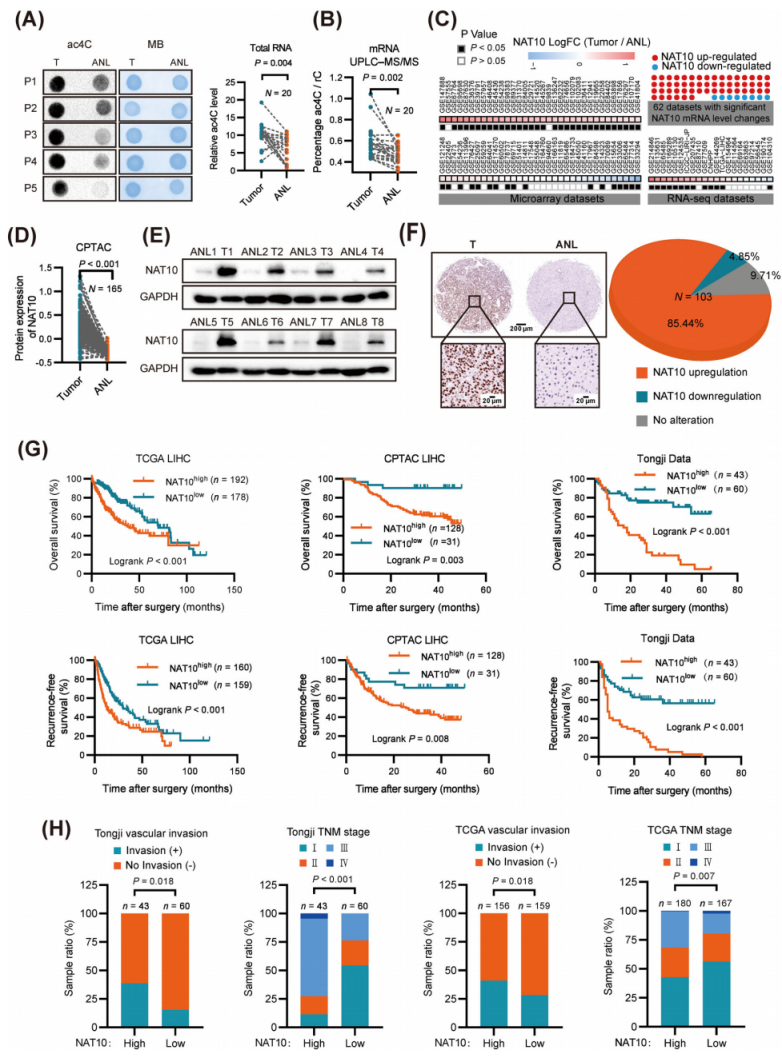
圖1.在HCC患者中,NAT10表達升高與預后不良相關
2.下調NAT10可抑制HCC的增殖和轉移
為了研究NAT10在肝細胞癌(HCC)中的功能,研究人員使用NAT10表達和ac4C修飾水平均升高的細胞系(MHCC-97H和SNU449)建立了穩定的NAT10敲低細胞系。與對照shRNA(shCtrl)相比,NAT10的敲低顯著降低了總RNA和mRNA中的ac4C含量(圖2A)。NAT10沉默顯著抑制了HCC細胞的活力(圖2B-C)、克隆形成能力(圖2D)以及軟瓊脂菌落形成效率(圖2E)。此外,傷口愈合遷移、Transwell遷移和基質膠侵襲實驗表明,NAT10沉默顯著抑制了MHCC-97H和SNU449細胞的遷移和侵襲能力(圖2F-G)。隨后,研究人員評估了NAT10在體內對HCC增殖和轉移的影響。腫瘤異種移植研究表明,NAT10沉默顯著抑制了腫瘤生長,表現為與對照細胞來源的腫瘤相比,腫瘤大小和重量減少(圖2H)。此外,腫瘤異種移植中NAT10的敲低導致細胞增殖受到抑制并誘導凋亡,這分別通過Ki-67和末端脫氧核苷酸轉移酶介導的脫氧尿苷三磷酸缺口末端標記(TUNEL)染色得到證實(圖2I-J)。此外,在肝臟原位植入模型中,與對照組相比,接種NAT10敲低細胞的組肝內腫瘤結節的體積和數量顯著減少(圖2K)。此外,在通過向裸鼠的側尾靜脈注射NAT10敲低細胞和陰性對照細胞建立的肺轉移模型中,NAT10沉默顯著抑制了HCC的肺轉移(圖2L)。綜上所述,這些發現表明NAT10在HCC的增殖和轉移中作為致癌驅動因子發揮著關鍵作用。
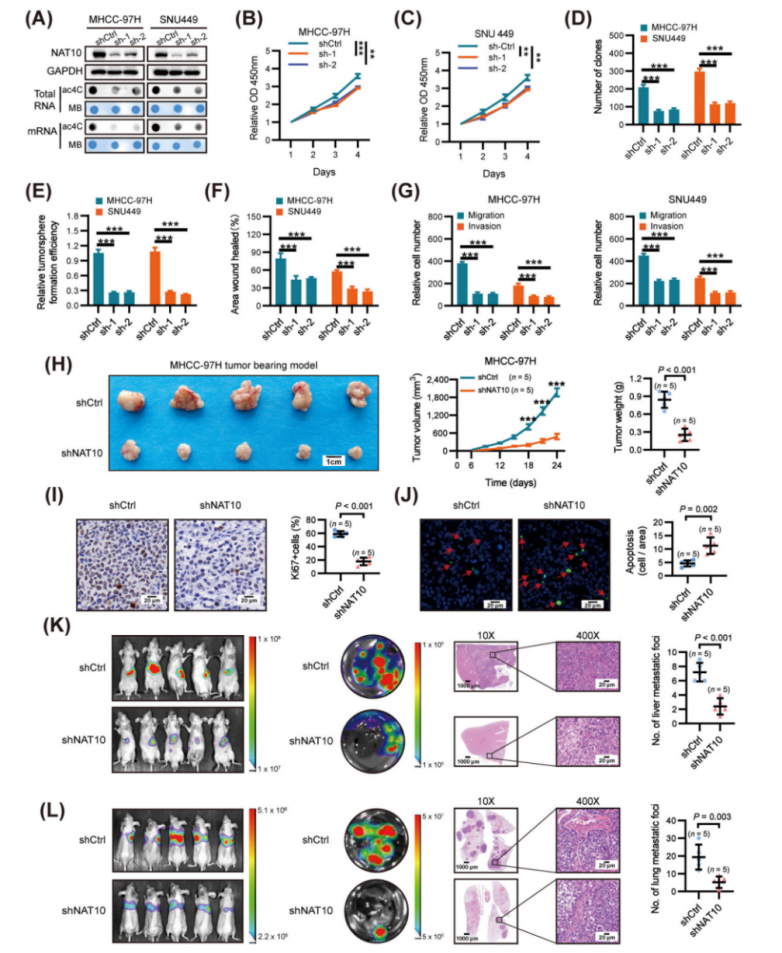
圖2.在體外和體內,NAT10敲低抑制HCC進展
3.NAT10對mRNA ac4C修飾和全局mRNA翻譯的影響
分別對NAT10敲除和不敲除的MHCC-97H細胞中進行了acRIP-seq實驗(圖3A)。確定了對照組細胞中來自4784個ac4C修飾的轉錄本的共11591個ac4C峰,以及NAT10缺陷細胞中來自691個ac4C修飾的轉錄本的3148個峰(圖3B-C)。值得注意的是,在穩定的NAT10敲除細胞中出現了609個新的峰,而9052個峰消失了(圖3B)。由于NAT10是一種ac4C乙酰轉移酶,因此這9052個獨特的峰預計包含NAT10的真正靶標。在檢測到的峰中富集了ac4C共有基序“CXX”(圖3D),這與先前的研究結果一致。隨后,研究人員比較了有或沒有shNAT10的HCC細胞中的acRIP-seq數據,分析了差異ac4C峰及其對應的轉錄本。在shNAT10細胞中鑒定出125個轉錄本顯示出ac4C峰減少(圖3F),這些結果共同表明NAT10在HCC中介導ac4C mRNA乙酰化。通過RNAseq和Ribo-seq實驗,鑒定受NAT10介導的ac4C修飾影響的下游功能效應子(圖3G)。NAT10的耗竭極大地改變了基因轉錄表達和核糖體保護片段(RPF)的豐度(圖3H)。從RNA-seq中,在NAT10耗竭后檢測到635個下調和818個上調的轉錄本。從Ribo-Seq中,NAT10敲低后鑒定出277個下調和332個上調的轉錄本。mRNAs ac4C(-)在響應NAT10缺失時顯示出特定的T.E(翻譯效率)升高(圖3I)。多聚體分析顯示,在NAT10缺陷細胞中,80S單體和多聚體的組裝顯著減少(圖3J),表明NAT10的耗竭抑制了全局蛋白質翻譯。此外,使用SUnSET試驗測定時,NAT10的耗竭顯著抑制了蛋白質合成(圖3K)。所有這些結果表明NAT10介導的mRNA ac4C修飾增強了肝細胞癌中的全局翻譯效率。
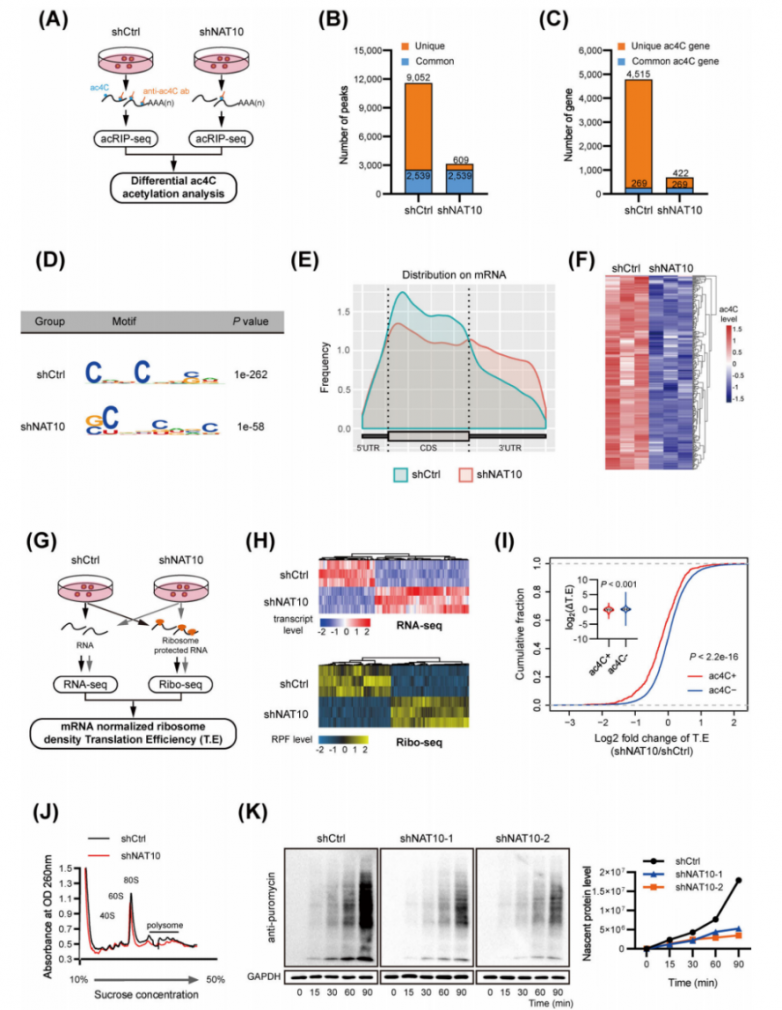
圖3.NAT10對mRNA ac4c修飾和全局mRNA翻譯的影響
4.NAT10介導的ac4C修飾增強HMGB2 mRNA的翻譯
研究人員將來自acRIP-seq、RNA-seq和Ribo-seq的重疊候選基因進行重疊,以精確定位下游靶標(圖4A)。在潛在的NAT10下游靶標(HMGB2、HIF0、PITX1和STC2)中,HMGB2在NAT10耗竭后顯示出最顯著的下調(圖4B-C),這表明HMGB2可能是HCC細胞中NAT10的直接靶標。acRIP-seq和Ribo-seq數據顯示,在NAT10缺陷細胞中,CDS中的ac4C富集和核糖體占據率顯著降低(圖4D)。相應地,NAT10敲低顯著降低了HMGB2 mRNA的ac4C水平和蛋白質表達(圖4E-F),而其mRNA豐度未受影響。有趣的是,使用MG132抑制蛋白酶體未能恢復NAT10沉默的HCC細胞中HMGB2的蛋白質表達(圖4G),這表明NAT10誘導的HMGB2表達不受蛋白質降解變化的影響。將HMGB2 CDS連接到多克隆位點(MCS)來構建了pmirGLO-HMGB2熒光素酶報告基因,雙熒光素酶測定清楚地表明,與對照細胞相比,NAT10缺陷細胞中HMGB2的翻譯效率顯著降低(圖4H,補充圖S4B-C)。此外,與對照細胞相比,NAT10缺陷細胞中HMGB2 mRNA在核糖體組分中的分布顯示翻譯活性多聚體(> 80S)顯著減少(圖4I)。這些綜合結果表明,ac4C誘導的HMGB2表達與翻譯調控有關。
在NAT10敲低細胞中過表達HMGB2顯著恢復了細胞的體外增殖和侵襲能力。此外,體內實驗表明,HMGB2完全挽救了NAT10敲低后的異種移植瘤生長和肺轉移(圖4J-L)。該數據表明,HMGB2是NAT10的關鍵功能性靶標。此外,在同濟醫院和CPTAC隊列中分析了HMGB2的臨床相關性,揭示了HCC組織中HMGB2的表達升高。相關性分析進一步揭示了HCC中高表達的HMGB2與NAT10水平之間存在顯著關聯(圖4M-N)。此外,生存分析表明,這兩個基因的高表達均預示著最差的總體生存期(OS)和無復發生存期(RFS)。綜上所述,NAT10介導的ac4C修飾通過增強HMGB2的翻譯促進了HCC的惡性進展。
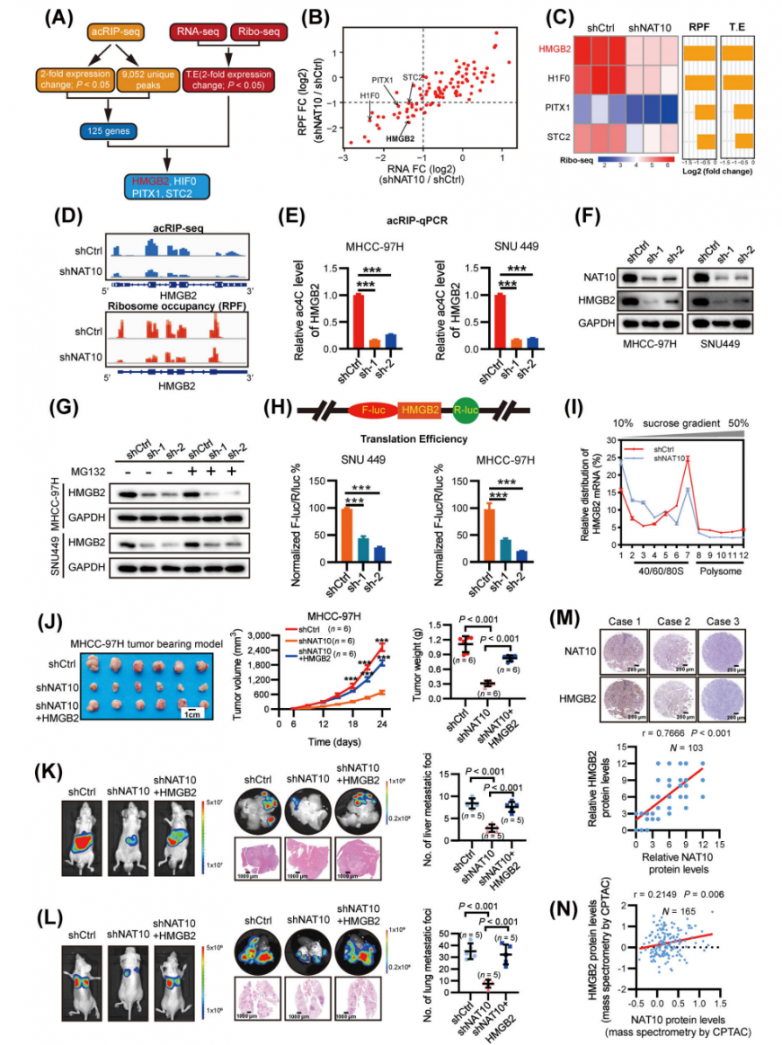
圖4.ac4C的修飾增強了HMGB2的翻譯
5.HMGB2 mRNA的CDS ac4C位點增強eEF2的結合
RNA的乙酰化也可能影響相互作用蛋白的結合,這與特異性結合蛋白通過介導mRNA翻譯來識別RNA中的N6-甲基腺苷相似。為了鑒定直接結合ac4C修飾的蛋白質,研究人員使用含有或不含ac4C的生物素標記寡核苷酸進行了RNA親和色譜法和數據非依賴性采集(DIA)蛋白質組學定量檢測(圖5A-B)。結果,在ss-ac4C組中,檢測到123種蛋白質。GO分析表明,蛋白質主要富集在翻譯延伸和翻譯等方面(圖5C)。此外,還在STRING蛋白質-蛋白質相互作用(PPI)數據庫中搜索了這些鑒定出的蛋白質,以查找已知的PPI,并根據通過GO分析獲得的已知功能對蛋白質節點進行了分組。根據這些蛋白質已知的生物學功能,將它們分為六個主要亞群,包括翻譯、靶向內質網、核糖核蛋白等。所有這些結果都表明,ac4C修飾參與了翻譯過程。對ss-ac4C和acFUS結合蛋白進行重疊分析,鑒定出了eEF2和SRP68(圖5D-E)。RNA下拉實驗證實,eEF2和SRP68優先結合ac4C修飾的寡核苷酸(圖5F)。隨后,為了確定eEF2或SRP68是否參與HMGB2翻譯的調控,首先通過瞬時siRNA介導的eEF2和SRP68敲低來評估HMGB2的表達。結果發現,eEF2敲低后HMGB2蛋白顯著下調。此外,RNA下拉實驗進一步證實,eEF2確實對ac4C修飾的RNA顯示出更高的結合能力(圖5G)。這表明eEF2是ac4C乙酰化mRNA的特異性結合蛋白。此外,內源性eEF2的RNA免疫沉淀(RIP)顯示,eEF2結合的RNA中ac4C修飾顯著富集。此外,NAT10的耗竭相應減少了eEF2在80S核糖體和多核糖體中的分布,這支持了eEF2作為ac4C識別器的觀點。為了驗證eEF2是否參與HMGB2 mRNA的ac4C乙酰化,使用RIP-qPCR研究了HMGB2 mRNA與eEF2之間的相互作用。數據顯示,eEF2在HMGB2 mRNA中顯著富集,而在NAT10缺陷細胞中,這種相對富集被顯著抑制(圖5H)。NAT10的過表達導致HMGB2蛋白表達上調,而eEF2敲低后這種上調被顯著減弱。這些發現表明eEF2參與了ac4C修飾調控的HMGB2表達。
使用ac4C抗體對有無NAT10缺陷的肝癌細胞中的片段化RNA進行了免疫沉淀(圖5J)。結果表明,ac4C主要富集在HMGB2的外顯子1/2/3和5′UTR,而不是3′UTR。有趣的是,NAT10缺陷細胞中,外顯子2、外顯子3和5′UTR的ac4C富集顯著降低,而外顯子1則沒有觀察到類似效應(圖5J)。HMGB2 5′UTR-報告基因熒光素酶測定結果顯示,對于野生型和突變型5′UTR構建體,NAT10缺陷細胞與對照組之間在翻譯上沒有顯著差異。研究人員構建了一個僅包含野生型HMGB2 CDS的表達構建體,以及在CXX富集區引入C到T的突變,構建了三種突變型HMGB2 CDS變體(突變體1/2/3),在所有三種突變體中,HMGB2蛋白水平幾乎完全恢復(圖5K)。相應地突變了pmirGLO-HMGB2熒光素酶報告基因,并進行了雙熒光素酶測定,結果顯示,所有三種突變體都減弱了NAT10對HMGB2翻譯的抑制作用(圖5L),這表明HMGB2外顯子2和外顯子3中的乙酰化是ac4C調控HMGB2 mRNA翻譯的關鍵位點。為了驗證eEF2是否參與HMGB2 mRNA中已確定的三個ac4C乙酰化位點,進行了RNA免疫沉淀-定量PCR(RIP-qPCR)來探究HMGB2 mRNA與eEF2之間的相互作用。RIP-PCR的結果顯示,eEF2主要與HMGB2 mRNA中已確定的乙酰化CDS區域相互作用,而不是5′UTR區域(圖5M)。這一相互作用通過RNA下拉實驗得到了進一步證實,該實驗驗證了eEF2與HMGB2乙酰化CDS區域的結合(圖5N)。這些數據強烈表明,eEF2可能是肝癌細胞中ac4C誘導的HMGB2 mRNA翻譯的關鍵因子。
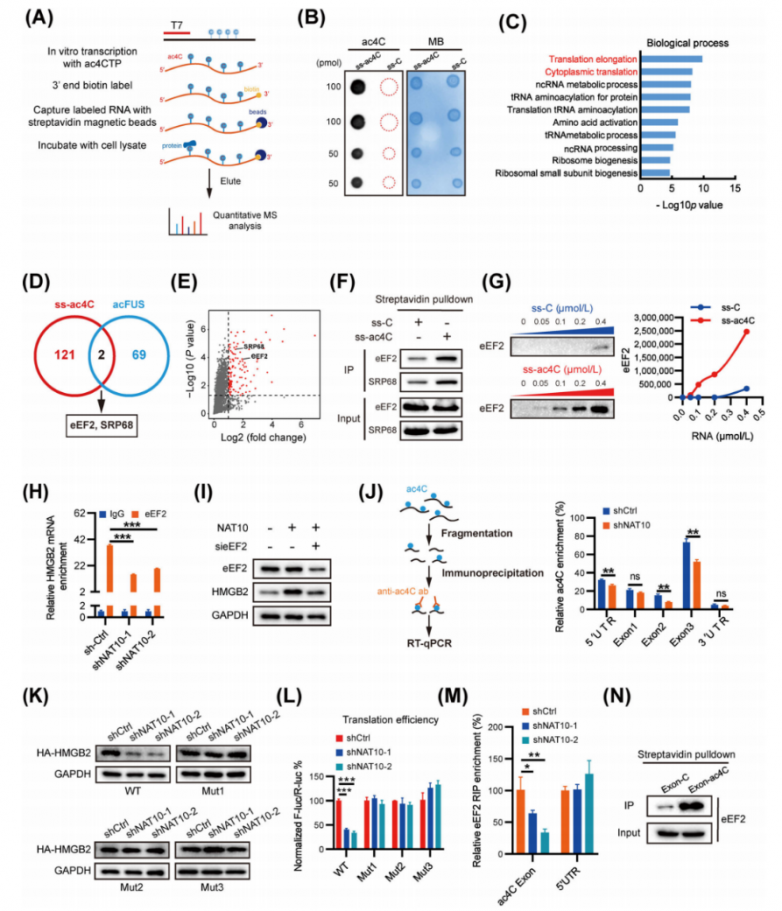
圖5.HMGB2 mRNA的CDS ac4C位點增強了eEF2的結合
6.帕比司他(Panobinostat)作為NAT10介導的ac4C抑制劑的鑒定與表征
研究人員構建了表達野生型NAT10或其催化突變體(G641E)的質粒,已知該突變體會損害NAT10的RNA乙酰轉移酶功能。分析結果顯示,與野生型細胞相比,催化突變體NAT10的細胞中ac4C水平顯著降低(圖6A)。重要的是,研究人員發現NAT10的ac4C催化活性域(G641)對于其促進HCC細胞增殖和侵襲的作用至關重要。此外,催化突變體NAT10的過表達顯著抑制了蛋白質合成。同時,催化突變體NAT10的過表達對HMGB2蛋白水平或mRNA ac4C水平沒有影響(圖6A)。研究人員基于結構的虛擬篩選、NAT10的催化口袋、抗腫瘤活性等方法選擇了帕比司他作為NAT10抑制劑(圖6B)。對接模型表明,帕比司他緊密結合NAT10蛋白并阻斷其催化口袋(圖6C)。隨后,表面等離子共振分析(圖6D)顯示帕比司他與NAT10之間具有高親和力(KD = 8.544 μM)。此外,帕比司他處理導致NAT10蛋白的熱穩定性發生顯著變化(圖6E),表明其能夠與NAT10結合。藥物親和力響應靶標穩定性(DARTS)試驗進一步證實了它們之間的直接相互作用(圖6F)。點印跡分析表明,帕比司他處理以劑量依賴的方式顯著降低了總RNA和mRNA中的全局ac4C豐度(圖6G-H)。此外,帕比司他處理顯著抑制了蛋白質合成并抑制了HMGB2的表達(圖6I)。而且,帕比司他在肝細胞癌細胞中導致HMGB2 mRNA的ac4C水平(圖6J)和HMGB2翻譯效率(圖6K)顯著降低。此外,富含在HMGB2 mRNA中的eEF2在帕比司他處理的細胞中受到顯著抑制(圖6L)。這些發現共同表明,帕比司他表現出對NAT10催化口袋的選擇性結合和占據,從而抑制靶標RNA轉錄本中的ac4C修飾。
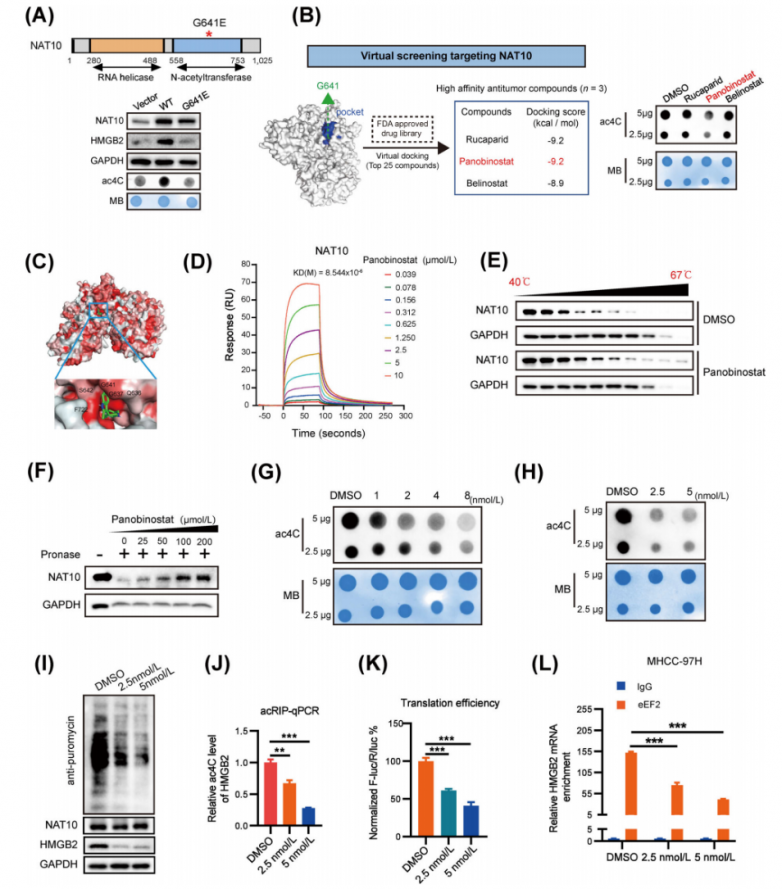
圖6.NAT10抑制劑帕比司他(panobinostat)的特征
7.帕比司他在體內和體外均表現出抗肝癌活性
帕比司他顯示出對MHCC-97H細胞生長的劑量依賴性抑制作用(圖7A),其半數抑制濃度(IC50)為4.469 nmol/L。與NAT10敲低一致,帕比司他顯著抑制了細胞增殖和侵襲(圖7B-C)。隨后,體內評估了帕比司他的抗肝癌作用(圖7D),發現其并未引起體重減輕。在皮下異種移植模型中,帕比司他以劑量依賴的方式有效抑制了異種移植腫瘤的生長(圖7E)。為了進一步驗證NAT10介導的ac4C在體內的抑制作用,研究人員分別使用點雜交和Western blot檢測了經帕比司他處理和對照小鼠異種移植腫瘤組織中的RNA ac4C水平和HMGB2蛋白表達。與對照小鼠相比,經帕比司他處理的小鼠RNA中的ac4C水平顯著降低(圖7F)。此外,帕比司他有效抑制了小鼠體內HMGB2的蛋白表達(圖7G)。組織病理學檢查進一步證實了帕比司他的療效,表明其對體內NAT10和HMGB2表達的抑制作用(圖7H)。此外,與對照組相比,經帕比司他處理的組肝內腫瘤結節的體積和數量均顯著減少(圖7I)。值得注意的是,與對照組相比,生物發光成像和肺轉移病灶定量結果表明,帕比司他治療顯著抑制了肝癌細胞的肺轉移(圖7J)。綜上所述,這些數據表明帕比司他是針對NAT10介導的ac4C的一種有效且安全的先導化合物,具有潛在的肝癌治療價值。
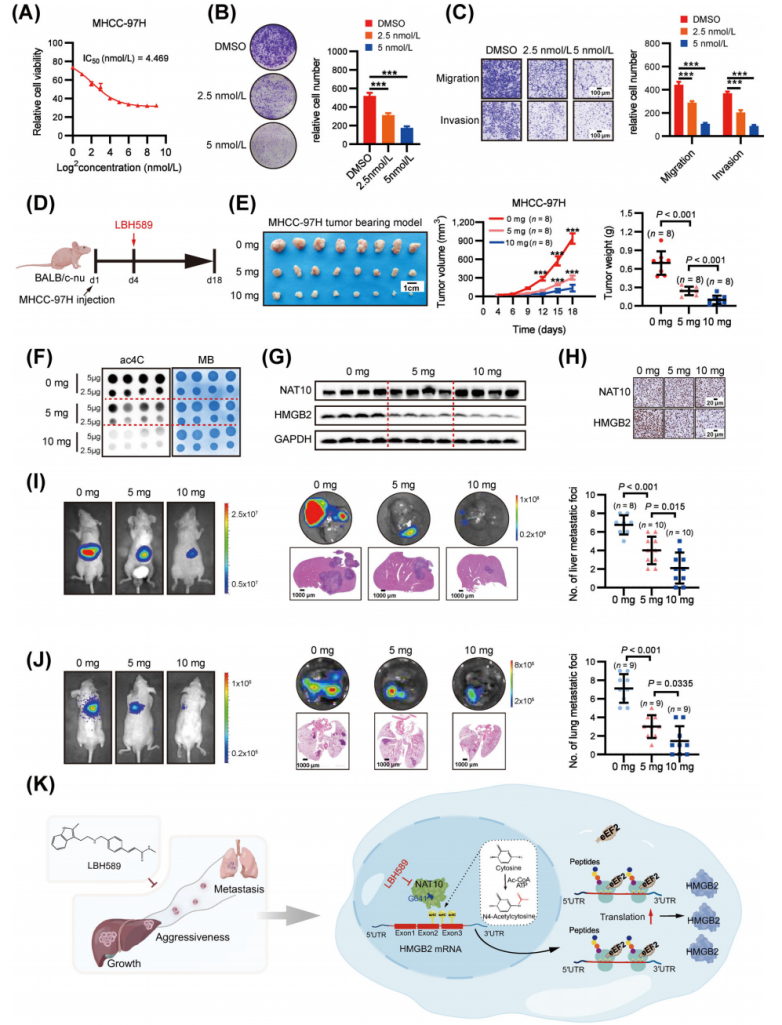
圖7.帕比司他在體外和體內均顯示出良好的抗HCC療效
研究結論
該研究確定了NAT10介導的ac4C修飾觸發了肝癌(HCC)中HMGB2的異常上調。作為NAT10的功能靶點,它刺激HMGB2 mRNA編碼序列(CDS)內的ac4C修飾,從而增強HMGB2的翻譯。此外,該研究還揭示了eEF2作為ac4C修飾mRNA的新型閱讀器,展示了其與HMGB2 mRNA CDS內ac4C位點的結合并促進HMGB2的翻譯。值得注意的是,該研究已經確定了帕比司他作為一種強效的NAT10-ac4C抑制劑,可有效阻止肝癌的進展。綜上所述,該研究闡明了NAT10介導的mRNA ac4C修飾在肝癌發展中的關鍵作用,并強調了NAT10/ac4C作為肝癌治療靶點的治療潛力。


版權及免責聲明:
1. 任何單位或個人認為南方企業新聞網的內容可能涉嫌侵犯其合法權益,應及時向南方企業新聞網書面反饋,并提供相關證明材料和理由,本網站在收到上述文件并審核后,會采取相應處理措施。
2. 南方企業新聞網對于任何包含、經由鏈接、下載或其它途徑所獲得的有關本網站的任何內容、信息或廣告,不聲明或保證其正確性或可靠性。用戶自行承擔使用本網站的風險。
3. 如因版權和其它問題需要同本網聯系的,請在文章刊發后30日內進行。聯系電話:01083834755 郵箱:news@senn.com.cn