- GlucoSober?二氫小檗堿,獨特晶型專利工藝
- 2024年07月12日來源:中國網
提要:隨著全球經濟的發展和生活方式的改變,肥胖、高血糖和高血脂已經成為威脅人類健康的三大主要問題。這些問題不僅影響個人的健康和生活質量,還對社會和經濟產生了巨大的負擔。
本文首發自微信公眾號德諾邦尚,我已委托“維權騎士”為我的文章進行維權行動。
隨著全球經濟的發展和生活方式的改變,肥胖、高血糖和高血脂已經成為威脅人類健康的三大主要問題。這些問題不僅影響個人的健康和生活質量,還對社會和經濟產生了巨大的負擔。而隨著有減肥或血糖控制需求的人群開始關注具有血糖調節功能的天然活性成分時,小檗堿因其具有多種生物活性,并具有不錯的血糖調節和脂肪調節活性而受到人們的青睞。
從2022年下半年開始,小檗堿在美國版抖音—TikTok上爆紅,起因是某消費者在TikTok上記錄了使用小檗堿減肥成功的經歷,收到了廣泛的傳播和討論,以及效仿。美國消費者稱小檗堿為“天然的Ozempic(司美格魯肽)”,用小檗堿減肥相關的視頻在短時間內就達到了累計上億的播放量。這一社交媒體現象促使歐美市場小檗堿產品熱賣,多家品牌商表示小檗堿產品均賣斷貨,甚至一度造成小檗堿的原料緊缺。
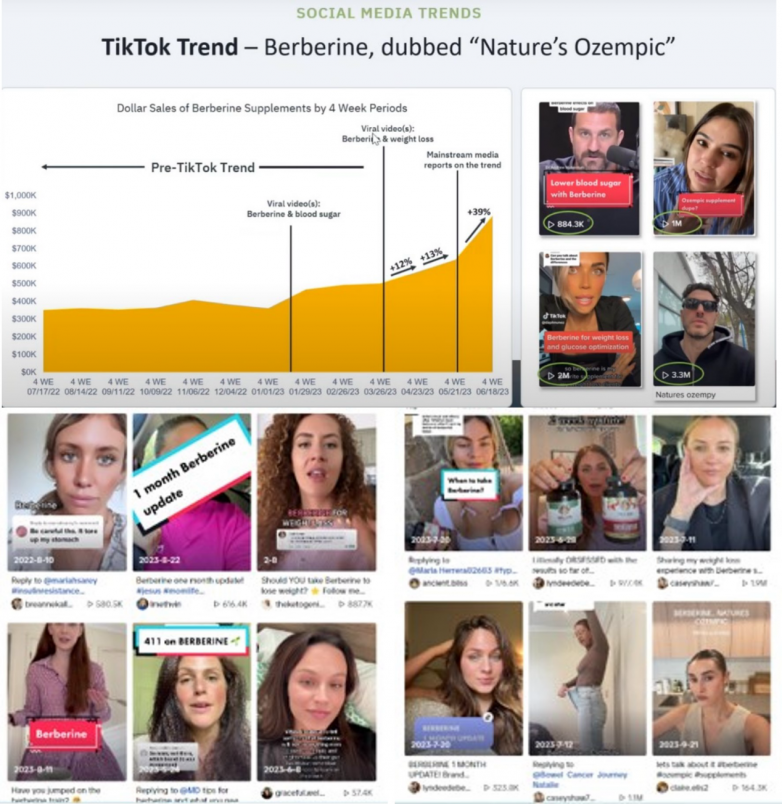
小檗堿,天然GLP-1,多重健康機制
小檗堿,又稱“黃連素”,具有悠久的使用歷史。在中國最早見于3000多年前的《神農本草經》,在印度的《阿育吠陀》藥典中也可見小檗堿的使用記載。小檗堿最初主要用于抗菌和抗病毒、以及止瀉等。近年來,隨著現代科學的發展,小檗堿的多種藥理作用逐漸被揭示,并廣泛應用于臨床實踐中。研究發現,小檗堿主要通過以下機制發揮健康效益。
01促進GLP-1分泌
通過促進胰高血糖素mRNA的表達與腸道L-細胞的增殖,增加GLP-1的分泌。[1]
通過激活在腸道中表達的苦味受體TAS2R38,刺激腸道L-細胞分泌GLP-1。[1]
02調節血糖代謝,改善胰島素抵抗
刺激胰島素受體的表達,增強胰島素敏感性,改善胰島素抵抗。[2]
上調葡萄糖轉運體Glut 4的表達,促進細胞吸收葡萄糖,從而降低血液中的葡萄糖水平。[3]
減少線粒體中氧氣的消耗和ATP的產生,抑制葡萄糖異生轉錄因子(G6Pase和PEPCK)的表達,抑制肝臟葡萄糖異生成,降低空腹血糖水平。[4]
03增加棕色脂肪含量,改善脂肪代謝
促進白色脂肪組織中與棕化基因的表達,增加棕色脂肪的數量,并能增強棕色組織的功能,促進能量消耗和產熱。[5]
通過AMPKα抑制與脂肪生成基因相關的轉錄子SREBPs和ChREBP的表達,進一步抑制脂肪酸合成酶的水平,減少脂肪沉積,改善脂肪代謝。[6,7]
04調節膽固醇代謝
下調酰基輔酶A、膽固醇酰基轉移酶-2的表達,減少細胞對膽固醇的攝取和細胞的單層通透性。[8]
上調甾醇27-羥化酶、膽固醇-7α-羥化酶的基因表達,抑制腸道對膽固醇的吸收。[9]
通過AMPK途徑,降低血漿中低密度脂蛋白膽固醇、游離脂肪酸和總膽固醇水平,并能提高血漿中高密度脂蛋白膽固醇水平。[10,11]
05緩解身體炎癥,減少氧化應激損傷
通過抑制激活蛋白1的結合來抑制環氧合酶-2的表達來發揮抗炎作用。[12]
通過復雜的機制如激活AMPK、抑制NF-κB和AP-1通路、調節Nrf2通路等,來改變氧化應激標志物和抗氧化酶的水平,并能減少促炎細胞因子如TNF-α、IL-13、IL-6、IL-8等在機體內的水平。[13]
06調節腸道菌群,改善代謝紊亂
通過改變腸道菌群的結構和群落組成,如抑制有害菌,增加雙歧桿菌等有益菌的生長,尤其是能夠增加產生短鏈脂肪酸的菌群數量,從而使腸道菌群更豐富多樣。[14]
通過調節微生物-腸道-腦軸改善代謝紊亂。[15]
小檗堿應用中的局限性
盡管小檗堿在血糖代謝和體重體質管理方面受到市場熱捧,但是各品牌方陸續發現其在應用上卻存在著較大的局限性,如生物利用度低,腸道吸收率差,起效劑量大、造成植物需求量大,生態環境壓力大;以及高劑量使用會帶來的一些身體不適,如部分人出現過敏反應;高劑量會導致腹痛、腹瀉、惡心、脹氣、便秘和胃痛等不良反應;有些人甚至會由于高劑量的小檗堿而導致動脈低壓、呼吸困難,出現類似流感的癥狀,以及心臟損傷和胃潰瘍等[16]。
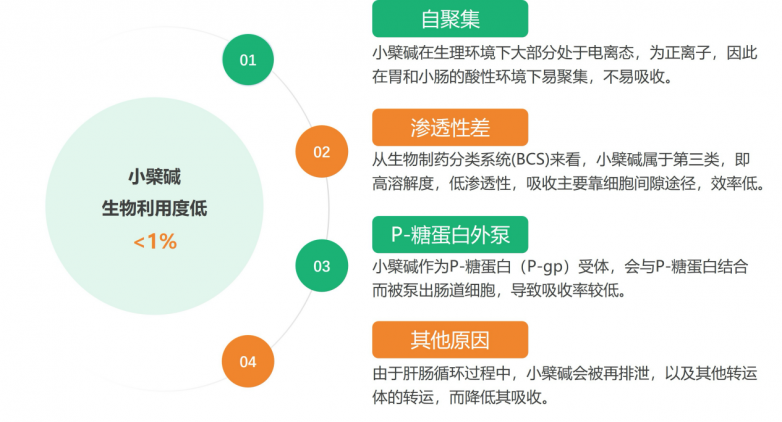
造成小檗堿生物利用度低的原因[16]
二氫小檗堿,生物利用度更佳的小檗堿
二氫小檗堿是一種天然存在的生物堿,是小檗堿的一種生物活性形式,在結構與功能上與小檗堿相似。但是,二氫小檗堿具有比小檗堿更高的生物利用度、更強的功效、以及更好的安全性。
二氫小檗堿生物利用度更高的原因是,小檗堿經口服進入腸道后,會在腸道內被還原為二氫小檗堿,經腸壁吸收后再轉化為小檗堿進入血液中發揮作用。因此,二氫小檗堿可以更快地被腸壁吸收,因而使其生物利用度比小檗堿高。
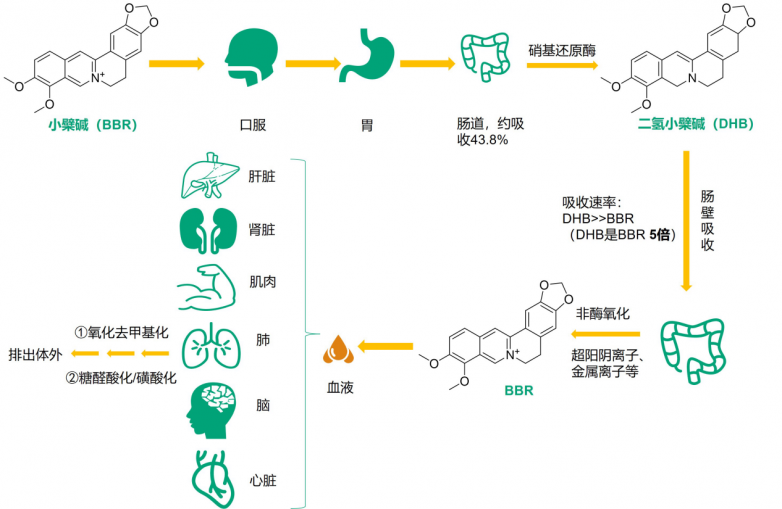
小檗堿在體內的代謝過程[17]
二氫小檗堿,比小檗堿更佳的吸收率
體外吸收:研究表明,以人結腸癌細胞系中的Caco-2細胞為模型,發現二氫小檗堿的吸收速率是小檗堿的11.9倍,外流比率是小檗堿的1/20。[17]
動物體內吸收:研究表明,二氫小檗堿以200mg/kg的劑量灌喂大鼠,在血漿中檢測到的二氫小檗堿水平低于10ng/mL,而小檗堿的AUC(0-t)值為261.8nm/mL*h,Cmax為52.47nm/mL,說明二氫小檗堿在腸道內幾乎完全轉化為小檗堿;而在同時飼喂200mg/kg二氫小檗堿和200mg/kg小檗堿的情況下,二氫小檗堿組的血漿中小檗堿AUC(0-t)值和Cmax分別為小檗堿組的4.8倍和3.25倍,表明二氫小檗堿的腸道吸收更好,更有利于提高血漿中小檗堿的水平。[17]
人體劑量研究:在一項口服100mg、200mg二氫小檗堿和500mg小檗堿的人體實驗中發現,100mg和200mg劑量的二氫小檗堿可使體內血漿的小檗堿水平大于500mg小檗堿劑量組。
二氫小檗堿,比小檗堿更好的健康效益
降糖減脂:相較于小檗堿而言,二氫小檗堿可以更有效地減少脂肪量和降低葡萄糖水平,且僅需100mg/kg劑量的二氫小檗堿即可具有與560mg/kg劑量的小檗堿相類似的降糖和減脂效果,甚至更佳。[19]
抗動脈粥樣硬化:MMP-9(金屬蛋白酶-9)和EMMPRIN(細胞外基質金屬蛋白酶誘導劑)在動脈粥樣斑塊易損性中具有重要作用,而二氫小檗堿相較于小檗堿而言,可顯著降低EMMPRIN的表達,有利于改善動脈粥樣硬化。[20]
抗潰瘍性結腸炎:研究表明,二氫小檗堿可顯著減輕由葡聚糖硫 酸鈉引起的臨床癥狀與腸道組織損傷。通過促進腸壁保護蛋白MUC的表達,有利于腸道屏障功能恢復,并能阻斷TLR4/MyD88/NF-κB信號通路、降低促炎細胞因子水平。在相同劑量下二氫小檗堿對結腸炎的效果更優于小檗堿。[18]
二氫小檗堿安全性數據
急性毒性研究:通過大鼠進行的急性口服毒性試驗表明,二氫小檗堿的LD50大于2000mg/kg,這表明二氫小檗堿具有很好的安全性;14天的口服毒性劑量范圍試驗表明,二氫小檗堿的最大耐受量為120mg/kg;90天的亞慢性毒性試驗表明,二氫小檗堿在劑量為100mg/kg時,無不良反應發生[22]
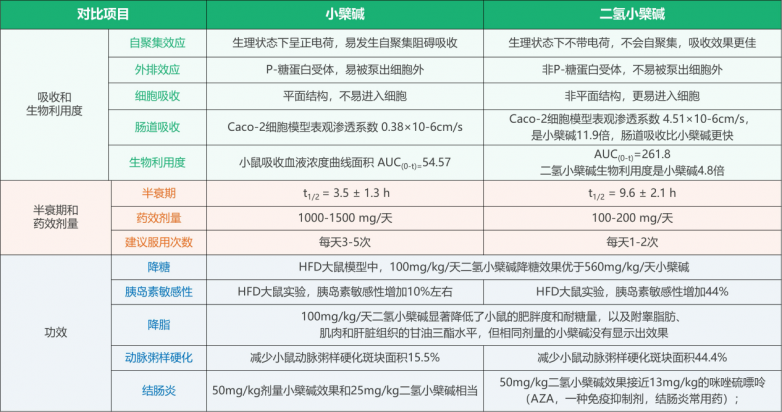
二氫小檗堿與小檗堿的比較(1)

二氫小檗堿與小檗堿的比較(2)
GlucoSober?二氫小檗堿,工藝專利&獨特晶型
隨著二氫小檗堿在減肥、降糖方面的功效受到持續關注以來,相應的需求與日俱增。二氫小檗堿因為生物活性高,產品抗氧化性強,很容易氧化降解。為解決普通二氫小檗堿見光易降解易結塊等應用難題,Bonerge開發了獨特晶型的穩定性強高品質的GlucoSober?二氫小檗堿。
本著可持續發展,人與自然和諧發展的經營理念,GlucoSober?通過獨家專利的獨創生物催化工藝,利用寶貴且日益貧瘠的植物資源,生產出更多高品質的GlucoSober?二氫小檗堿,獨特晶型專利工藝。
為了更方便下游片劑和膠囊產品的生產加工,GlucoSober?率先開發了高密度的二氫小檗堿,產品具有更好的流行性,加工過程中減少原料的浪費,更加環保和高效。

高品質原料是制造優質產品的基礎,這是Bonerge在參加多個國際論壇與展會后與專家們達成的一個共識。
Bonerge將會持續不斷的,一如既往的加大產品研發和循證營養學投入,與全球的合作伙伴一起把GlucoSober?應用到更多健康領域,堅守用愛做產品,讓更多消費者因為我們的產品而獲得健康效應是我們由衷的喜悅和創新的動力源泉。
參考文獻
[1] YU Y, HAO G, ZHANG Q, et al. Berberine induces GLP-1 secretion through activation of bitter taste receptor pathways [J]. Biochem Pharmacol, 2015, 97(2): 173-7.
[2] KONG W J, ZHANG H, SONG D Q, et al. Berberine reduces insulin resistance through protein kinase C-dependent up-regulation of insulin receptor expression [J]. Metabolism, 2009, 58(1): 109-19.
[3] MI J, HE W, LV J, et al. Effect of berberine on the HPA-axis pathway and skeletal muscle GLUT4 in type 2 diabetes mellitus rats [J]. Diabetes Metab Syndr Obes, 2019, 12: 1717-25.
[4] XIA X, YAN J, SHEN Y, et al. Berberine improves glucose metabolism in diabetic rats by inhibition of hepatic gluconeogenesis [J]. PLoS One, 2011, 6(2): e16556.
[5] ZHANG Z, ZHANG H, LI B, et al. Berberine activates thermogenesis in white and brown adipose tissue [J]. Nat Commun, 2014, 5: 5493.
[6] REN G, GUO J H, QIAN Y Z, et al. Berberine Improves Glucose and Lipid Metabolism in HepG2 Cells Through AMPKalpha1 Activation [J]. Front Pharmacol, 2020, 11: 647.
[7] ZHU X, BIAN H, WANG L, et al. Berberine attenuates nonalcoholic hepatic steatosis through the AMPK-SREBP-1c-SCD1 pathway [J]. Free Radic Biol Med, 2019, 141: 192-204.
[8] WANG Y, YI X, GHANAM K, et al. Berberine decreases cholesterol levels in rats through multiple mechanisms, including inhibition of cholesterol absorption [J]. Metabolism, 2014, 63(9): 1167-77.
[9] KONG W, WEI J, ABIDI P, et al. Berberine is a novel cholesterol-lowering drug working through a unique mechanism distinct from statins [J]. Nat Med, 2004, 10(12): 1344-51.
[10] KIM W S, LEE Y S, CHA S H, et al. Berberine improves lipid dysregulation in obesity by controlling central and peripheral AMPK activity [J]. Am J Physiol Endocrinol Metab, 2009, 296(4): E812-9.
[11] JIANG D, WANG D, ZHUANG X, et al. Berberine increases adipose triglyceride lipase in 3T3-L1 adipocytes through the AMPK pathway [J]. Lipids in Health and Disease, 2016, 15(1).
[12] ZOU K, LI Z, ZHANG Y, et al. Advances in the study of berberine and its derivatives: a focus on anti-inflammatory and anti-tumor effects in the digestive system [J]. Acta Pharmacol Sin, 2017, 38(2): 157-67.
[13] LI Z, GENG Y-N, JIANG J-D, et al. Antioxidant and Anti-Inflammatory Activities of Berberine in the Treatment of Diabetes Mellitus [J]. Evidence-Based Complementary and Alternative Medicine, 2014, 2014: 1-12.
[14] ADEL-MEHRABAN M S, AGHABEIGLOOEI Z, ATLASI R, et al. Berberine as a Natural Modifier of Gut Microbiota to Promote Metabolic Status in Animal Studies and Clinical Trials: A Systematic Review [J]. 2023: 202-16.
[15] SUN H, WANG N, CANG Z, et al. Modulation of Microbiota-Gut-Brain Axis by Berberine Resulting in Improved Metabolic Status in High-Fat Diet-Fed Rats [J]. Obes Facts, 2016, 9(6): 365-78.
[16] XU H-Y, LIU C-S, HUANG C-L, et al. Nanoemulsion improves hypoglycemic efficacy of berberine by overcoming its gastrointestinal challenge [J]. Colloids and Surfaces B: Biointerfaces, 2019, 181: 927-34.
[17] FENG R, SHOU J-W, ZHAO Z-X, et al. Transforming berberine into its intestine-absorbable form by the gut microbiota [J]. Scientific Reports, 2015, 5(1).
[18] LI C, DONG N, WU B, et al. Dihydroberberine, an isoquinoline alkaloid, exhibits protective effect against dextran sulfate sodium-induced ulcerative colitis in mice [J]. Phytomedicine, 2021, 90.
[19] TURNER N, LI J Y, GOSBY A, et al. Berberine and its more biologically available derivative, dihydroberberine, inhibit mitochondrial respiratory complex I: a mechanism for the action of berberine to activate AMP-activated protein kinase and improve insulin action [J]. Diabetes, 2008, 57(5): 1414-8.
[20] KIM S, CHUNG J H. Berberine prevents UV-induced MMP-1 and reduction of type I procollagen expression in human dermal fibroblasts [J]. Phytomedicine, 2008, 15(9): 749-53.
[21] BUCHANAN B, MENG Q, POULIN M M, et al. Comparative pharmacokinetics and safety assessment of transdermal berberine and dihydroberberine [J]. PLoS One, 2018, 13(3): e0194979.
[22] LEWIS K D, FALK M. Toxicological assessment of dihydroberberine [J]. Food Chem Toxicol, 2022, 168: 113301.
免責聲明:
上述聲明均來源于科研文獻,未經過國家權威機構評估。本產品不用于診斷、治療、治愈或預防任何疾病。某些聲明可能不適用于所有地區,產品標簽和相關聲稱根據不同政府要求可能會有所不同。解釋權歸邦尚所有。